
近日,生命学院沈锡辉教授团队张磊教授在《The ISME Journal》发表了题为“Autoinducer-2-mediated communication network within human gut microbiota”的研究论文,分析了人类肠道微生物菌群中群体感应信号分子AI-2的合成、感知基因的分布和表达规律以及作用模式,并揭示了AI-2介导的人类肠道微生物种间通讯网络。我校生命学院博士研究生樊擎莹、已毕业博士林雪媛以及复旦大学生命学院博士生孙恒玺为论文共同第一作者,张磊教授为论文的通讯作者。
QS信号分子AI-2广泛存在于细菌中,既能介导种内交流,又能介导种间交流,被称为“细菌的世界语”,但由于其广为人知的两类受体LuxP和LsrB仅在少数细菌中存在,人们对细菌如何感知该信号知之甚少。2020年本课题组发现原核生物通过一类广泛分布的具dCache_1结构域的跨膜受体感知AI-2实现物种间对话的新机制(Zhang et al., Nature Communications, 2020),随后基于这类受体构建了瘤胃微生物种间交流网络(Liu et al., Microbiome, 2022)。我们进一步发现具GAPES1结构域的第二信使c-di-GMP合成酶YeaJ是AI-2的另一类新受体,且这类受体在肠杆菌目革兰氏阴性菌中广泛存在(Li et al., Nature Communications, 2022)。此外,我们发现AI-2通过作用于具dCache_1结构域的组氨酸激酶调控胞内c-di-GMP水平,进而增强弗氏弧菌对氧化应激和DNA损伤的耐受性(Zhang et al., mBio, 2025)。
肠道菌群是人体内最复杂、最庞大的微生态系统,在这个复杂的微生物群落中微生物采用各种策略相互作用。作为细菌交流的主要方式,QS介导的细菌通讯网络在调节肠道微生态平衡及营养代谢等方面发挥重要作用。由于绝大多数QS信号仅能介导种内交流,作为唯一被公认能介导广泛种间交流的QS信号,AI-2在肠道微生物互作网络中必然发挥重要作用。然而,长期以来局限于AI-2受体未知,人们对肠道微生物中AI-2介导的种间交流知之甚少。我们前期发现的两类广泛分布的AI-2受体使得探究肠道中AI-2介导的细菌种间交流成为可能。本研究从来自UHGG数据集的目前最全的人类肠道微生物基因组序列资源中下载289232个原核基因组,并基于95%的ANI阈值确定4744个物种,进一步筛选出3329个具有高质量基因组的原核物种代表。通过分析这些物种中QS信号合成酶基因分布,在2353个物种中鉴定出7种QS信号合成酶编码基因,其中2039个物种具有AI-2合成酶编码基因,远高于其他QS信号合成酶基因的分布。进一步我们发现299个物种携带编码一种或多种AI-2受体的基因。其中dCache_1和GAPES1型受体可作为甲基化趋化受体、组氨酸激酶、c-di-GMP合成与水解酶、丝氨酸磷酸酶和丝氨酸/苏氨酸激酶发挥作用,反映人类肠道微生物菌群中AI-2介导的种间交流模式的多样性。宏转录组学分析显示许多AI-2合成酶和受体编码基因可以在健康或不健康人类肠道中表达。交流网络分析显示AI-2介导的相互作用广泛发生在厚壁菌门、变形菌门、放线菌门、弯曲菌门和螺旋体门成员之间。
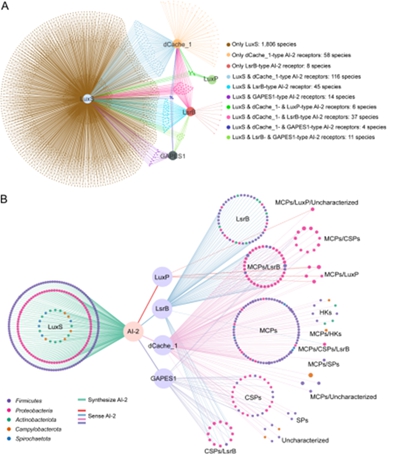
本研究首次对人类肠道微生物群的QS系统进行了系统性梳理,并确证AI-2介导的群体感应是其中占据主导地位的通讯方式。这一成果呈现了迄今最全面的AI-2信号介导人类肠道微生物种群间相互作用的图景,不仅加深了对人类肠道微生物群中QS介导的通讯网络的理解,也为探索AI-2介导的微生物相互作用在人类健康与疾病中的作用提供了重要的理论和实践参考,并为基于复杂微生物相互作用构建合成肠道菌群提供新的理论依据。
本研究得到了国家自然科学基金和陕西省杰出青年基金等项目的资助。
编辑:王学锋
终审:刘玉峰