
5月1日,西北农林科技大学张涌院士团队联合任刚教授团队、华中农业大学/崖州湾国家实验室赵书红教授团队,在《Cell Genomics》期刊发表题为“Super RNA Pol ll domains enhance minor ZGA through 3D interaction to ensure the integrity of major transcriptional waves in late-ZGA mammals”的重要研究成果。
哺乳动物不同物种的发育速度存在显著差异,这不仅体现在胚胎植入后的妊娠时长各异,也反映在着床前胚胎启动合子基因组激活(Zygotic genome activation, ZGA)的过程中。以ZGA发生的早晚划分(图1),猪和小鼠属于早ZGA物种(2-4细胞期ZGA),牛和人则属于晚ZGA物种(8-16细胞期ZGA)。RNA聚合酶II(RNA polymerase II, Pol II) 作为转录事件的核心酶,通常被转录因子(Transcriptional factors, TFs)招募至基因启动子区域,与其他转录起始复合物协同启动基因转录。最近的研究发现,哺乳动物中Pol II还可结合基因组非编码区域,影响增强子对靶基因调控。先前研究证实了组蛋白修饰、染色质可及性和DNA甲基化等表观状态在配子和胚胎发育的初始阶段呈现显著的种间差异,而在胚胎ZGA发生后趋于保守和一致,并提出了“沙漏模型”作为解释。然而这些染色质状态是如何影响Pol II结合并调控种间ZGA的时序差异;以及Pol II对这些物种,特别是对晚ZGA物种的合子基因组激活的调控机制目前尚不清楚。
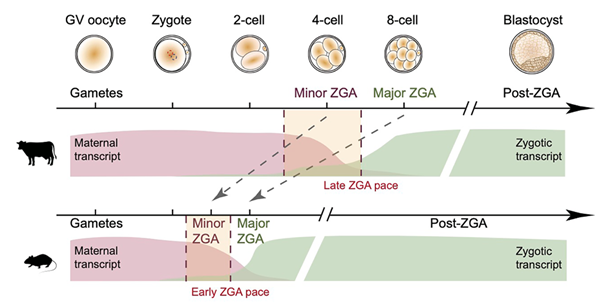
图1.相对于鼠,牛ZGA发生更晚
该研究绘制了包含Pol II、ATAC、Hi-C、Total-RNA在内的九个维度的牛、猪配子和着床前胚胎的表观和转录图谱,首次发现在晚ZGA物种牛胚胎中存在赖于Pol II的三维基因组结构域,并将此特殊结构域命名为超级RNA聚合酶II结构域(Super Pol II domains, SPDs)。进一步研究发现SPDs通过增强牛minor ZGA基因表达,保证major ZGA基因正确表达和胚胎正常发育。更重要的是,在人类胚胎(晚ZGA物种)中也观察到类似结构并发挥功能,而小鼠和猪胚胎(早ZGA物种)中并未观察到此现象。综合分析发现,SPDs调控的minor ZGA基因的高表达促使晚ZGA物种在major ZGA阶段基因表达模式与早ZGA物种趋同,确保其major ZGA转录波的准确开启和胚胎正常发育。

图2. SPDs通过三维染色质互作增强了晚ZGA物种中minor ZGA基因的表达,促使晚ZGA物种在major ZGA阶段基因表达模式与早ZGA物种趋同,确保了晚ZGA物种major ZGA转录波的准确开启和胚胎的发生
这项研究揭示了Pol II在不同物种启动ZGA的时间差异中发挥的独特作用,拓展了对不同物种胚胎发育速度差异调控机制的理解,为深入揭示哺乳动物早期胚胎发育速度差异的分子机制提供了重要数据支撑和理论基础。
西北农林科技大学张涌院士、任刚教授,华中农业大学/崖州湾国家实验室赵书红教授、赵云霞主任科学家为论文的通讯作者。西北农林科技大学张景程博士、博士生李恒宽、吴杰、宋霖节、李林密助理实验师为论文的共同第一作者,华中农业大学刘鑫副研究员、中国农业科学院潘章源研究员、湖南农业大学周川教授、崖州湾国家实验胡明阳博士后、西北农林科技大学博士生刘自晓、焦美、董震宇、张和煦、石斌强和李文莹硕士等人也做出了重要贡献。该研究得到国家生物育种重大专项、国家自然科学基金创新群体和陕西省畜禽育种“两链”融合重点项目的资助。
编辑:张晴
终审:刘玉峰