
RNA干扰(RNAi)是真核生物古老的病毒防御途径,在非脊椎动物、植物和真菌中尤其有效。病毒产生的双链 RNA(dsRNA)被细胞识别后会触发靶标 RNA 裂解,生成由22-23 个核苷酸组成的初级小干扰RNA(primary siRNA)。primary siRNA作为模板,在RNA依赖性RNA聚合酶(RdRP)的作用下产生次级siRNA(secondary siRNA)。随后这些secondary siRNA加载到Argonaute蛋白上并与病毒RNA互补,使具有RNA切割活性的Argonaute蛋白降解病毒RNA。在哺乳动物中,RNAi抗病毒的作用已经部分被干扰素系统取代,但是在干细胞等特定的细胞或组织中,RNAi依然在抗病毒过程中发挥主导作用。增强RNAi反应不仅可以作为额外的病毒防御机制,并为RNAi疗法的开发提供了生物学基础。
近日,未来农业研究院毛凯教授团队与2024年诺贝尔生理学或医学奖获得者、美国哈佛医学院麻省总医院Gary Ruvkun教授团队合作,在PNAS上发表了题为“Caenorhabditis elegans inositol hexaphosphate pathways couple to RNA interference and pathogen defense”的研究论文。该研究通过分子遗传学和细胞生物学的方法发现肌醇六磷酸IP6调控秀丽隐杆线虫的抗病毒RNAi和哺乳动物细胞的免疫反应,为增强天然免疫防御机制提供了新的靶点,对通过RNAi抵御病毒感染提供了新的策略。
该研究在识别介导线粒体功能障碍监测的调控因子的遗传筛选中,意外地发现了肌醇多磷酸多激酶IPMK/IPMK-1(inositol polyphosphate multikinase)突变体增强了RNAi介导的外源遗传元件的沉默。针对磷酸肌醇生物合成途径的进一步探索,揭示了肌醇五磷酸2激酶IPPK-1/IPPK产生的IP6具有通过腺苷脱氢酶ADAR 抑制RNAi反应的功能(图1)。
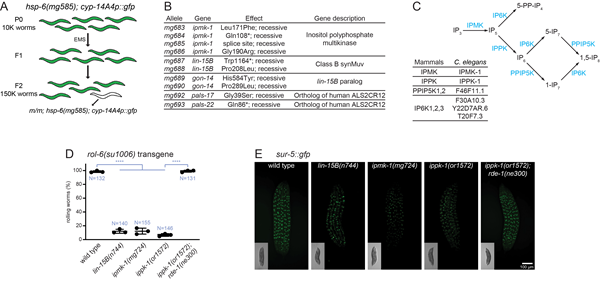
在ADAR介导的mRNA A-to-I 编辑的结果中显示,ippk-1 突变体中的 A-to-I 编辑完全丧失。而转录组分析表明抗病毒 RNAi 反应和未折叠蛋白反应(unfolded protein response, UPR)在IP6缺失的线虫体内激活。这两种应激反应的激活均需要RNA感应蛋白 RIG-I/MDA5 的线虫同源蛋白DRH-1。同时,UPR的激活需要 Argonaute蛋白RDE-1和转录因子XBP-1,但不需要 Mutator MUT-16,这一结果表明primary siRNA(而非secondary siRNA)的产生是UPR的触发因素。在哺乳动物细胞中敲除 IPPK 会导致ADAR1被蛋白酶体降解,并激活免疫反应和UPR(图2)。因此,IP6并通过ADAR介导线虫和哺乳动物细胞的免疫应答。
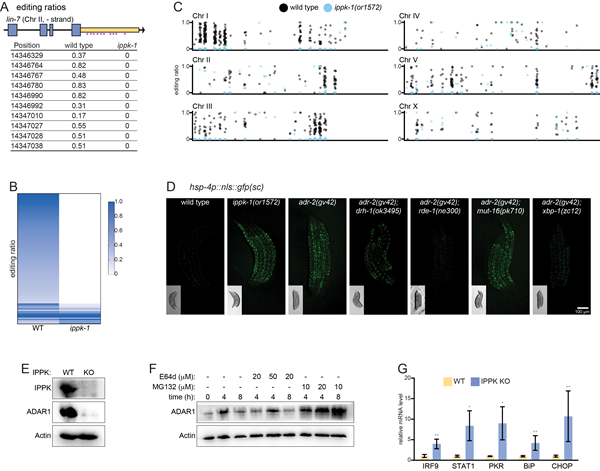
图2. IP6通过ADAR介导免疫和UPR变导致A-to-I编辑缺陷并激活UPR。A. 在野生型和ippk-1突变体中lin-7 3' UTR的编辑位点和比率;B. 野生型和ippk-1突变体中编辑位点和比率的热图;C. 线虫基因组上编辑位点和比率的分布;D. 不同突变体对UPR的影响。E. IPPK敲除导致HEK293T细胞中ADAR1蛋白水平降低 。F. MG132抑制ADAR1蛋白降解。G. IPPK敲除细胞中免疫和UPR基因mRNA水平上调
未来农业研究院毛凯教授和美国哈佛医学院麻省总医院Gary Ruvkun教授是本文的共同通讯作者,博士研究生徐文静为本文的第一作者。该研究得到了国家自然科学基金和西北农林科技大学前沿交叉创新团队计划资助。
编辑:王学锋
终审:李筱英